来源:NFYY鞍区肿瘤与下丘脑研究课题z
TDP-43 overexpression in the hypothalamus drives neuropathology, dysregulates metabolism and impairs behavior in mice
Sofia Bergh et al. Acta Neuropathologica Communications (2025) 13:119
这篇发表于《Acta Neuropathologica Communications》2025年第13卷第119期的研究论文,由Sofia Bergh及其团队撰写,探讨了TAR DNA结合蛋白43(TDP-43)在下丘脑中的过表达如何导致神经病理、代谢功能障碍和行为缺陷。
背景:
TDP-43病理是肌萎缩性侧索硬化症(ALS)、额颞叶痴呆(FTD)和亨廷顿病(HD)等神经退行性疾病的关键特征。这些疾病共同表现出代谢和情绪失调,这可能与下丘脑的病理改变有关。在临床ALS患者的尸检中,发现下丘脑存在TDP-43包涵体,并且调控代谢和情绪的神经肽(食欲素/orexin、黑色素浓缩激素/MCH、催产素/oxytocin)表达神经元选择性缺失。 研究目的:
旨在调查下丘脑中TDP-43的作用是否与神经病理学发展以及代谢和行为改变之间存在因果关系。 方法:
研究人员构建了一种腺相关病毒(AAV)载体,使其在神经元特异性突触蛋白启动子(synapsin promoter)的调控下表达人源野生型TDP-43。该载体被双侧注射到野生型FVB/N小鼠的下丘脑中。 主要发现:
TDP-43过表达导致下丘脑病理,呈剂量依赖性,重现了临床病理特征,包括下丘脑萎缩以及食欲素、MCH和催产素表达神经元的丢失。 在下丘脑中发现了TDP-43的核内和胞浆内包涵体。 过表达TDP-43的小鼠出现代谢失调,表现为高血糖,且与食物摄入量无关。 此外,过表达TDP-43的小鼠运动活性降低,筑巢能力受损,提示其发展出一种类冷漠(apathy-like)表型。 结论:
AAV载体介导的下丘脑TDP-43过表达可导致神经病理,并引发代谢功能障碍和类冷漠行为。这些结果表明TDP-43可在下丘脑中直接发挥病理效应,可能促成TDP-43蛋白病中非运动性表型的发生。
第一阶段:提出问题与建立模型 (Introduction & Experiment I)
明确临床观察与知识空白(提出问题):
引言 (Introduction) 开篇点题:
TDP-43病理与ALS、FTD、HD等神经退行性疾病密切相关。 指出共同的非运动症状:
这些疾病共享代谢和情绪失调等早期非运动性特征。 关联到下丘脑:
临床研究(尸检、MRI)发现ALS/FTD/HD患者存在下丘脑萎缩和特定神经元(食欲素、MCH、催产素)的丢失,且在ALS/FTD患者下丘脑中发现了TDP-43包涵体。 提出研究空白:
尽管观察到这些相关性,但“下丘脑病理与这些疾病表现之间是否存在直接因果关系,尚未完全建立”。 提出假说:
作者明确提出“我们假设TDP-43在下丘脑中直接发挥病理效应,导致行为和代谢改变。” 明确研究目标:
通过AAV载体介导的TDP-43在小鼠下丘脑中的过表达,来建立因果关系。 模型构建与初步验证(验证可行性):
成功在下丘脑中实现了TDP-43的广泛免疫反应性,表明模型构建成功。 初步观察到食欲素和催产素神经元数量呈剂量依赖性减少,且泛素免疫反应性(提示蛋白聚集)也呈剂量依赖性增加,并出现了泛素阳性包涵体。 同时初步显示了星形胶质细胞增生和小胶质细胞激活(炎症反应)。 方法:
生成了AAV载体,利用神经元特异性启动子(synapsin promoter)驱动人源野生型TDP-43表达,并将其双侧注射到小鼠下丘脑。 实验I (剂量依赖性验证):
首次尝试使用三种不同滴度的AAV-TDP43载体注射,并进行定性评估。 结果(Experiment I):
论证递进:
这一阶段的核心是**“可行性验证”**。它证明了研究团队能够成功地在下丘脑中诱导TDP-43的过表达,并且这种过表达确实能够引起类似于人类疾病的初步神经病理改变(神经元损伤、蛋白聚集、炎症),且具有剂量效应。这为后续的定量和功能研究奠定了基础。
第二阶段:深化病理学特征与特异性验证 (Experiment II)
定量化病理学特征(提升严谨性):
证实了下丘脑体积显著萎缩。 定量确认
了食欲素、MCH和催产素神经元的显著丢失。 关键发现:加压素神经元未受影响。
问题:
实验I是定性观察,需要更精确的定量数据来支持神经元丢失和组织萎缩的结论。 方法(Experiment II):
选择了在实验I中显示出最明显病理效应的最高滴度AAV-TDP43。对下丘脑体积进行定量测量,并对食欲素、MCH、催产素和加压素表达神经元进行定量计数。 结果(Experiment II):
论证递进:
这一步从“可能存在”到“确实存在且可量化”。特别是加压素神经元的未受影响,增强了研究的严谨性,因为它重现了临床ALS患者中神经元丢失的“选择性”,而不是普遍的神经元死亡,这使得模型与人类疾病的相似度更高,从而增强了其转化研究的价值。 排除了非特异性效应(提升结论可靠性):
AAV-GFP组未显示明显的神经病理。 AAV-mHTT组则显示了已知的食欲素神经元丢失(作为阳性对照,证明模型可检测到其他致病蛋白的效应)。 问题:
注入AAV或任何蛋白过表达都可能导致毒性,如何确定观察到的病理效应是TDP-43特异性的,而不是病毒载体本身或简单蛋白过表达的非特异性结果? 方法(Experiment II):
使用了AAV-GFP(表达无病理功能的绿色荧光蛋白)和AAV-mHTT(表达另一种已知致病蛋白突变亨廷顿蛋白)作为对照组,并进行相同滴度的注射和病理分析。 结果(Experiment II):
论证递进:
这一步是**“排除他因”**。通过使用适当的对照,研究者有效地排除了所观察到的病理效应是由于病毒载体毒性或普遍的蛋白过表达所致的可能性,从而将结论牢牢地锁定在“TDP-43过表达特异性导致”这一核心点上。
第三阶段:连接病理与宏观功能障碍 (Experiment III)
探索代谢功能(验证核心假说):
问题:
TDP-43导致的下丘脑病理,尤其是涉及代谢调节神经元的丢失,是否会引起代谢紊乱? 方法(Experiment III):
鉴于前两阶段确认了剂量效应和病理的特异性,选择了中等滴度(1.0×10^14 gc/ml),以期获得更长期的、适合行为学和代谢观察的疾病进展。对小鼠进行长期体重监测、DEXA体脂扫描和血清葡萄糖测量。 结果(Experiment III):
观察到TDP-43过表达小鼠体重显著增加、体脂百分比升高(肥胖)和血清葡萄糖水平升高(高血糖)。同时发现下丘脑体积萎缩与体重增加呈负相关。 论证递进:
这是直接“因果关联”的关键一步。它证实了下丘脑TDP-43病理确实导致了与人类疾病相关的代谢功能障碍。体重增加和高血糖是重要的临床表征。 探索行为障碍(验证核心假说):
运动活性显著降低(开放场移动距离缩短、转棒跌落潜伏期缩短)。 高架十字迷宫显示探索行为减少(移动距离缩短,在中心停留时间增加,在臂上停留时间减少)。 强迫游泳测试中,不动时间无差异,但游泳能力保留。 问题:
TDP-43导致的下丘脑病理是否也会引起行为改变,特别是与情绪和运动相关的改变? 方法(Experiment III):
对小鼠进行一系列行为学测试:开放场、转棒(运动活性)、高架十字迷宫(焦虑、探索行为)和强迫游泳(抑郁样行为)。 结果(Experiment III):
论证递进:
这一步也直接验证了**“因果关联”**,表明下丘脑TDP-43病理能引起与人类疾病相关的行为缺陷。游泳能力保留这一结果至关重要,它暗示了运动活性的降低可能不是因为肢体瘫痪,而是更深层次的动机或驱动力问题,为下一阶段对“冷漠”的探索提供了线索。
第四阶段:细化行为表型与分子机制 (Experiment IV)
明确行为表型(聚焦特定症状):
筑巢行为显著降低,提供了支持“类冷漠”表型的直接证据。 食物摄入量未显著增加,这表明观察到的肥胖和高血糖可能独立于食物过量摄入。 问题:
既然运动能力不是完全丧失,且有动机下降的迹象,那么这是否就是ALS/FTD/HD中常见的“冷漠”症状?此外,之前的代谢紊乱是否与食物摄入量直接相关? 方法(Experiment IV):
为了排除混淆因素并聚焦冷漠,研究者引入了筑巢行为测试(作为衡量动机和日常活动的公认指标),并再次监测食物摄入量。 结果(Experiment IV):
论证递进:
这一步是“行为表型细化”。它将模糊的“运动活性降低”精确地指向了“类冷漠”这一具体的精神症状,这与人类疾病的复杂表型更加吻合。同时,排除了高食物摄入导致肥胖的直接原因,提示可能存在更复杂的代谢调节机制受损。 深入分子机制(揭示病理本质):
RNA测序确认了特定神经肽(食欲素、MCH、催产素等)前体和受体基因的mRNA水平下调,与神经元丢失和功能障碍的宏观现象相符。 发现了组成性外显子跳跃,但未观察到之前在TDP-43缺失模型中报道的特定隐匿性外显子的表达增加。 荧光免疫染色显示TDP-43蛋白发生核-浆易位并形成核内和胞浆内包涵体,重现了ALS/FTD的标志性分子病理。 问题:
TDP-43过表达在分子层面引起了哪些改变,尤其是其作为RNA结合蛋白和剪接调节器的功能是否受损? 方法(Experiment IV):
对下丘脑组织进行RNA测序,分析差异基因表达和外显子剪接模式。 结果(Experiment IV):
论证递进:
这是“机制探究”的核心。通过RNA测序,研究者从基因表达和剪接层面揭示了TDP-43过表达导致病理的分子基础,这对于理解TDP-43的功能获得或功能丧失机制至关重要。核-浆易位和包涵体的确认则进一步证实了模型在分子层面的临床相关性。
第五阶段:总结与展望 (Discussion)
整合所有发现,回应最初假说:
将所有实验阶段的发现(神经病理、代谢失调、类冷漠行为、分子机制)整合起来,明确指出它们共同支持了最初的假说:TDP-43在下丘脑的过表达确实能直接导致神经病理和多种非运动性功能障碍。 讨论临床意义与转化价值:
强调模型重现了人类疾病的关键特征(选择性神经元丢失、核-浆易位等),以及这些发现对理解疾病发病机制和开发新治疗靶点的重要性。 指出研究局限性:
坦诚地讨论了研究的局限性,如物种差异、单一性别、特定启动子限制、病毒扩散可能和行为学解释的复杂性。这体现了科学研究的严谨性。 提出未来研究方向:
基于局限性,展望了未来的研究,如在雄性小鼠中的验证、更精细的神经回路和细胞类型研究,以及更深入的机制探索。
总结:递进深入的论证链条
整篇论文的论证过程是一个典型的“从现象到机制,从宏观到微观,从定性到定量,从相关到因果”的逐步深入过程:
从临床观察出发:
发现人类疾病中TDP-43病理和下丘脑病理与非运动症状共存。 提出大胆假说:
下丘脑的TDP-43病理是这些非运动症状的直接原因。 构建并验证模型:
通过AAV技术,在小鼠下丘脑特异性过表达TDP-43,首先证明这种干预是可行且能诱导病理的(剂量依赖性、初步病理改变)。 量化并确认特异性:
通过精确的定量分析和严格的对照实验,证明了TDP-43诱导的下丘脑萎缩和选择性神经元丢失是特异且可复制的,与人类疾病高度相似。 连接病理与功能:
进一步观察到这种病理改变确实导致了代谢紊乱(肥胖、高血糖)和行为异常(运动减少、探索行为降低)。 精炼行为表型:
通过引入筑巢测试,将模糊的运动障碍明确为“类冷漠”,进一步提升了模型的临床相关性。 揭示分子机制:
最后,通过分子生物学手段(RNA测序、免疫荧光),深入探究了TDP-43在细胞和基因层面的病理学本质(核-浆易位、包涵体形成、剪接异常),为宏观现象提供了微观解释。
这种层层递进的逻辑结构,使得研究结论具有强大的说服力,不仅回答了最初提出的因果关系问题,也为后续的疾病机制研究和治疗开发提供了坚实的基础。
Fig. 1: Overexpression of TDP-43 induces neuropathology in the hypothalamus in a dose-dependent fashion.
(图1:TDP-43过表达以剂量依赖性方式诱导下丘脑神经病理。)
核心目的: 验证AAV-TDP43载体在下丘脑中的表达,并初步观察其对神经元和泛素化的剂量依赖性影响。
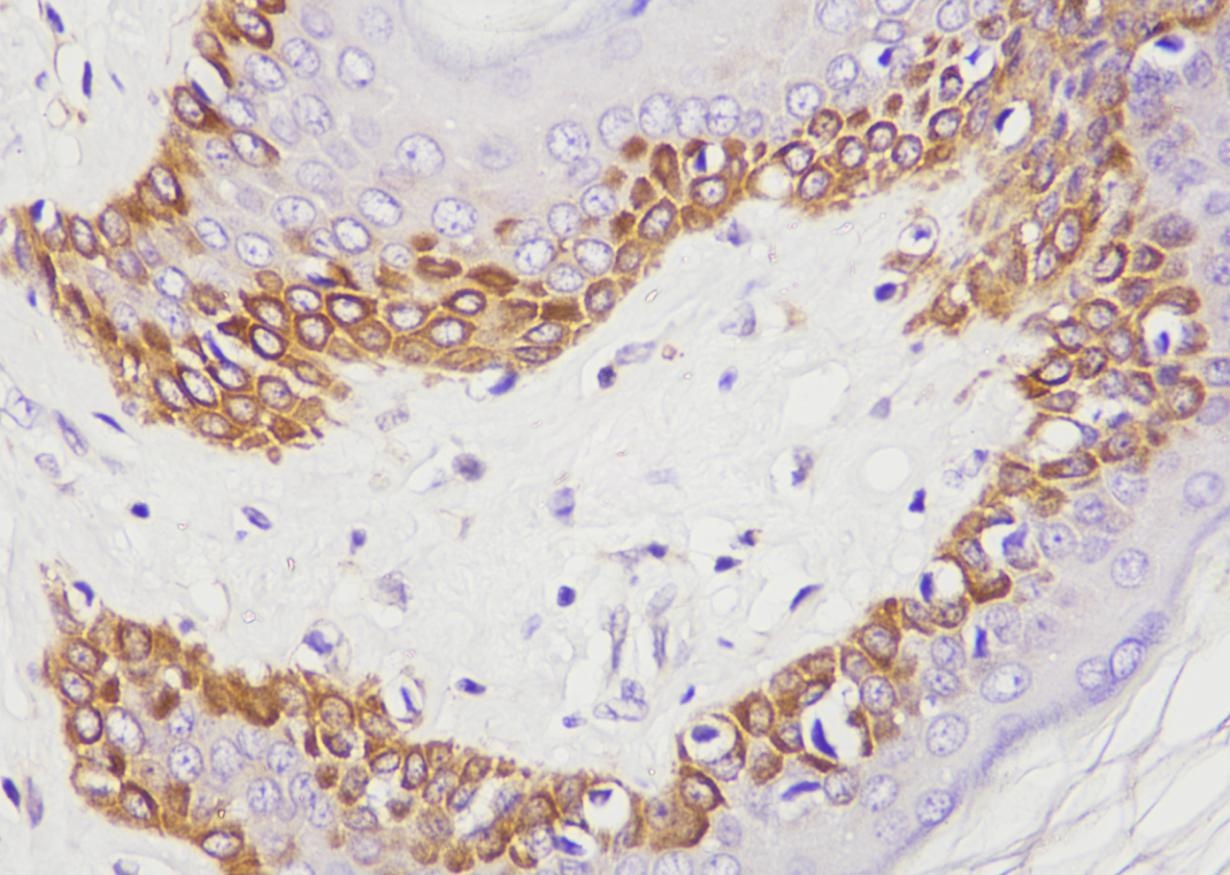
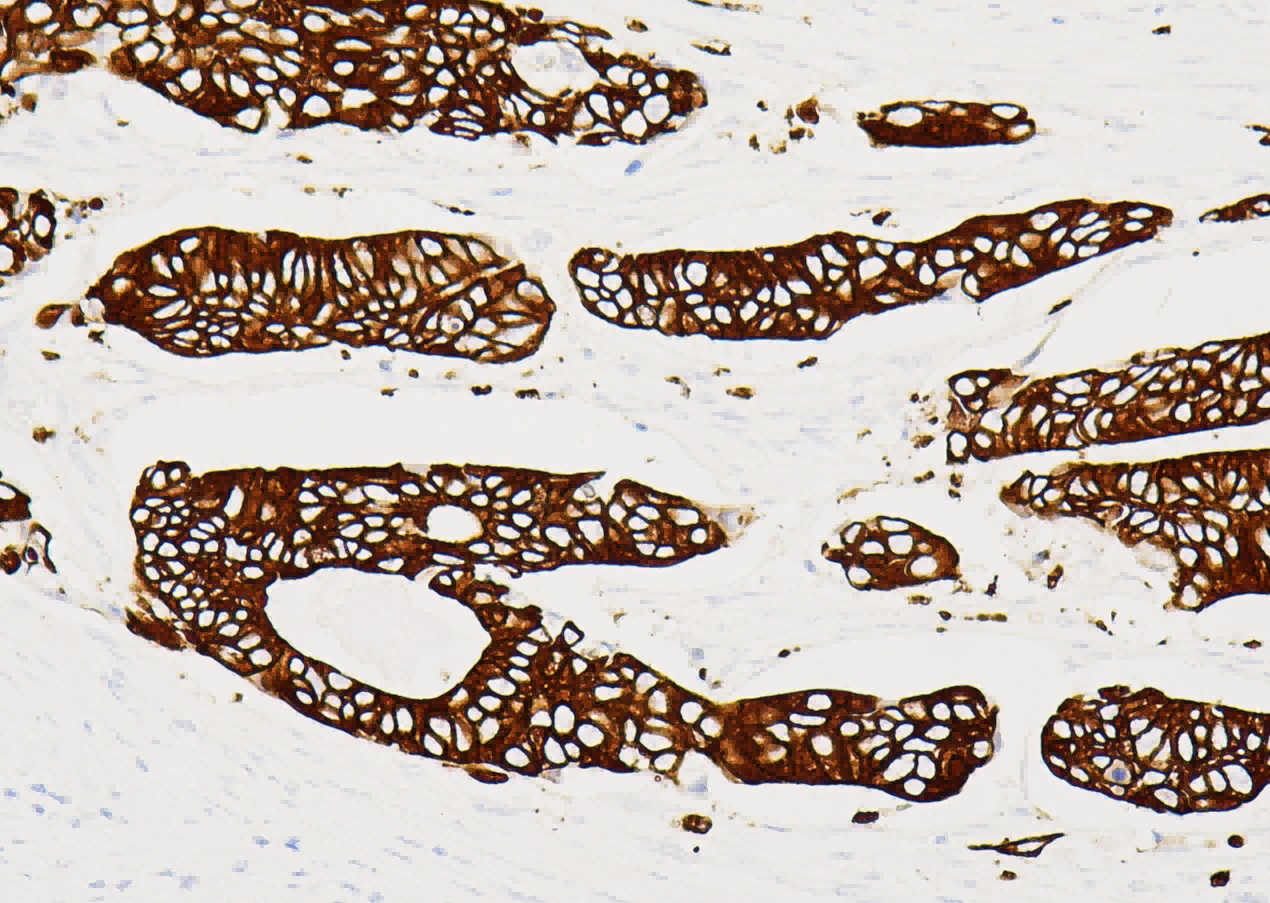
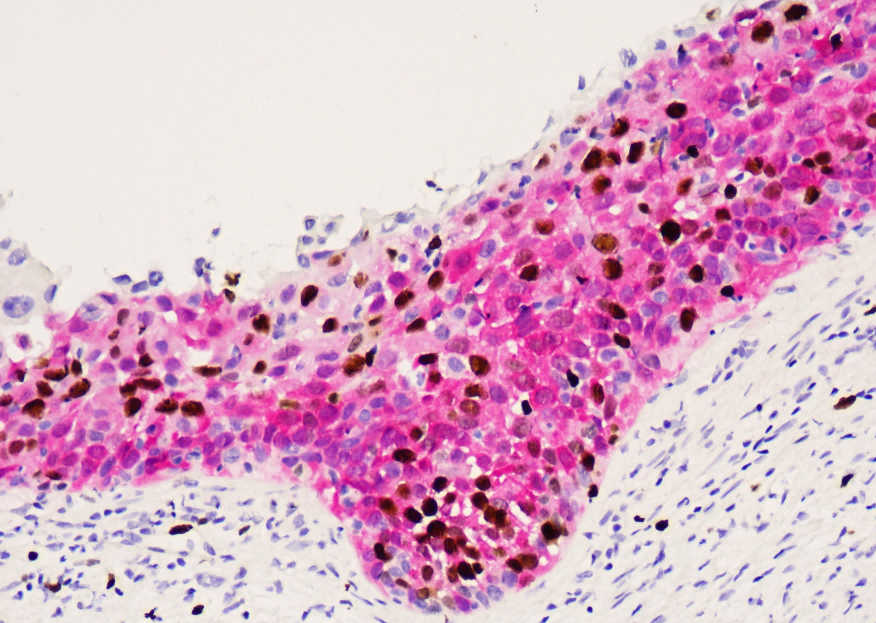
a. TDP-43 immunoreactivity was comparable in the hypothalamus across all injected groups.
内容:
展示了在注射不同滴度AAV-TDP43(5.0 × 10^13, 1.0 × 10^14, 2.5 × 10^14 gc/ml)后,小鼠下丘脑中的TDP-43免疫反应性(染色的棕色区域)。 解读:
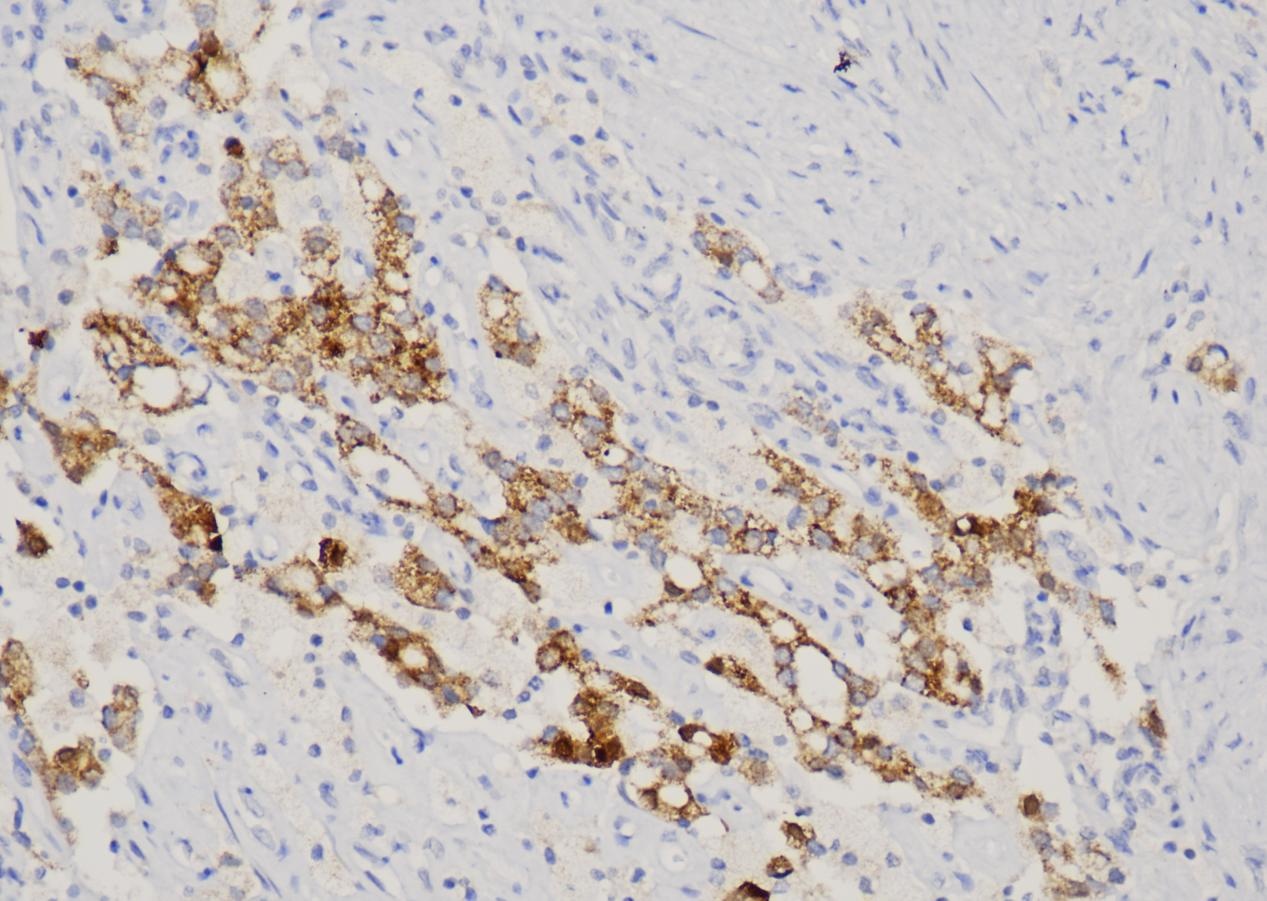
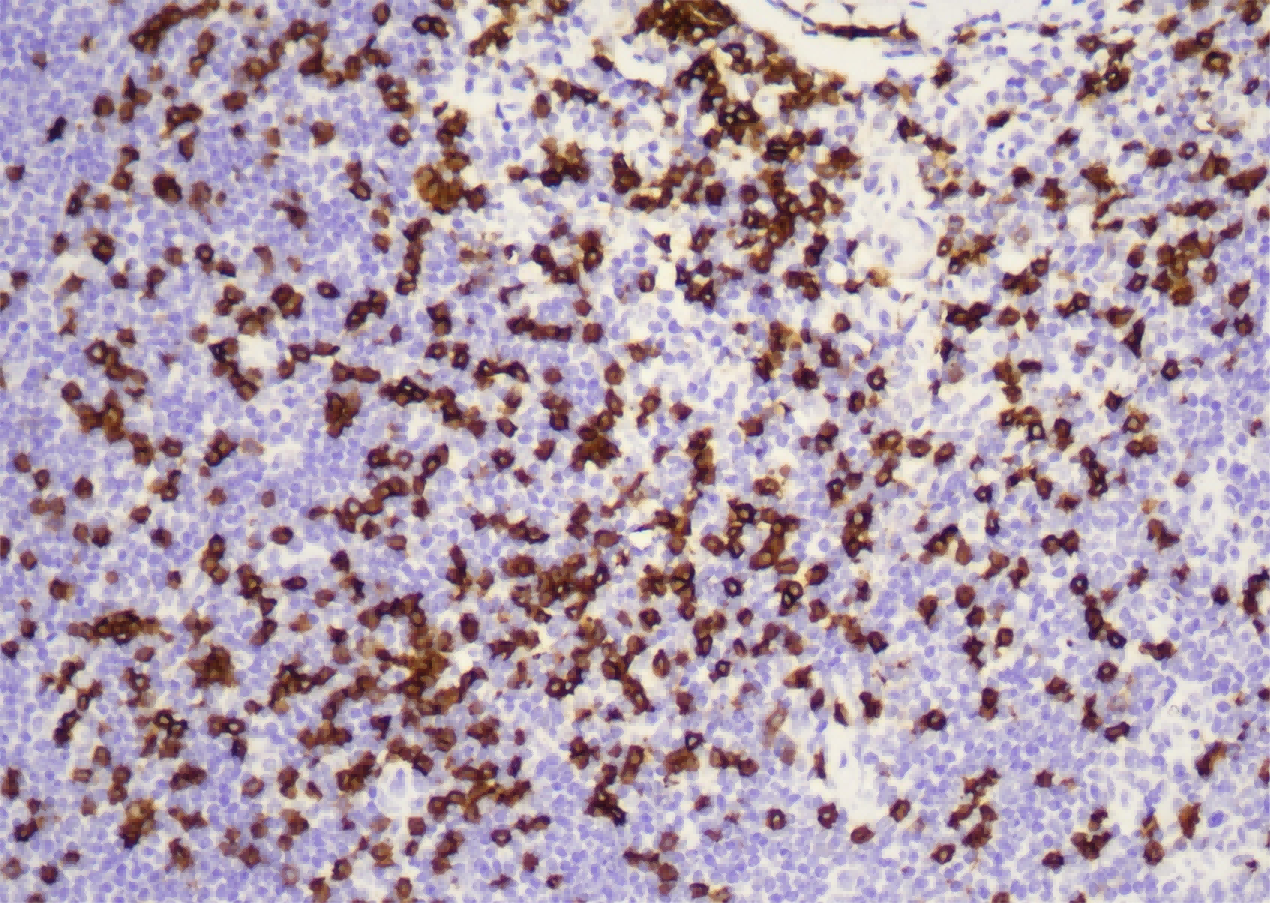
图像显示,所有注射组的下丘脑都有明显的TDP-43染色,表明AAV载体成功地在下丘脑表达了TDP-43。虽然标题说“comparable”,但从视觉上看,随着滴度升高,TDP-43的染色强度和范围似乎略有增加,这可能是定性观察,真正的“剂量依赖性”在下游的神经元影响中体现。 b. The number of neurons immunoreactive for hypocretin (b) and oxytocin © appeared to decrease in a dose-dependent fashion.
对照组:
食欲素和催产素神经元数量多且形态清晰。 低滴度组 (5.0 × 10^13 gc/ml):
神经元数量开始减少,但仍可见不少。 中滴度组 (1.0 × 10^14 gc/ml):
神经元数量明显进一步减少。 高滴度组 (2.5 × 10^14 gc/ml):
神经元数量大幅度减少,很多区域几乎看不到完整的阳性神经元,仅剩下稀疏的或破碎的染色。 结论:
这些图像直观地展示了TDP-43过表达对这两种神经元群体的毒性作用,且这种作用与AAV滴度(即TDP-43表达量)呈剂量依赖性。 内容:
展示了不同滴度AAV-TDP43注射后,下丘脑中食欲素(hypocretin)阳性神经元(b图)和催产素(oxytocin)阳性神经元(c图)的免疫染色图像。每个滴度组和对照组都显示了代表性的图像。 解读:
d. Neuronal loss was observed in the lateral hypothalamic area only in mice injected with the highest dose.
对照组:
神经元排列密集,数量多。 高滴度组:
神经元明显稀疏,数量减少,形态也可能受损。 结论:
CV染色进一步证实了TDP-43过表达(特别是高剂量时)导致了下丘脑区域的神经元丢失,而非仅仅是神经肽表达的下调。 内容:
展示了对照组和最高滴度AAV-TDP43注射组下丘脑外侧区(lateral hypothalamic area)的尼氏染色(Cresyl violet, CV)图像。尼氏染色可以显示神经元的胞体和尼氏小体,是评估神经元数量和形态的常用方法。 解读:
e. Mice injected with the AAV-TDP43 vectors showed increased ubiquitin immunoreactivity in a dose-dependent fashion with ubiquitin-immunopositive inclusions.
对照组:
泛素染色背景低,无明显异常。 低滴度组:
泛素染色开始出现一些小点或弥散状增加。 中滴度组:
泛素染色明显增强,可见更多、更大的泛素阳性包涵体。 高滴度组:
泛素染色非常强烈,充斥着大量的泛素阳性包涵体。 结论:
泛素化是蛋白质降解和异常聚集的标志。泛素化水平的剂量依赖性增加和包涵体的出现,有力地证明了TDP-43过表达导致了蛋白质稳态的破坏和异常蛋白聚集,这是神经退行性疾病的关键病理特征。 内容:
展示了不同滴度AAV-TDP43注射后,下丘脑中泛素(ubiquitin)的免疫染色图像。 解读:
总结图1: 图1通过定性图片展示了TDP-43过表达模型构建的成功,以及该过表达如何以剂量依赖性方式诱导下丘脑神经元丢失(食欲素、催产素)、整体神经元减少(尼氏染色)和异常蛋白聚集(泛素化),为后续的定量分析和功能研究奠定了基础。
Fig. 2: TDP-43 overexpression causes hypothalamic atrophy with selective loss of hypocretin-, oxytocin- and melanin concentrating hormone (MCH)-expressing neurons.
(图2:TDP-43过表达导致下丘脑萎缩,并选择性丢失食欲素、催产素和黑色素浓缩激素(MCH)表达神经元。)
核心目的: 对图1的初步发现进行定量化验证,并确认神经元丢失的选择性,使模型更具临床相关性。
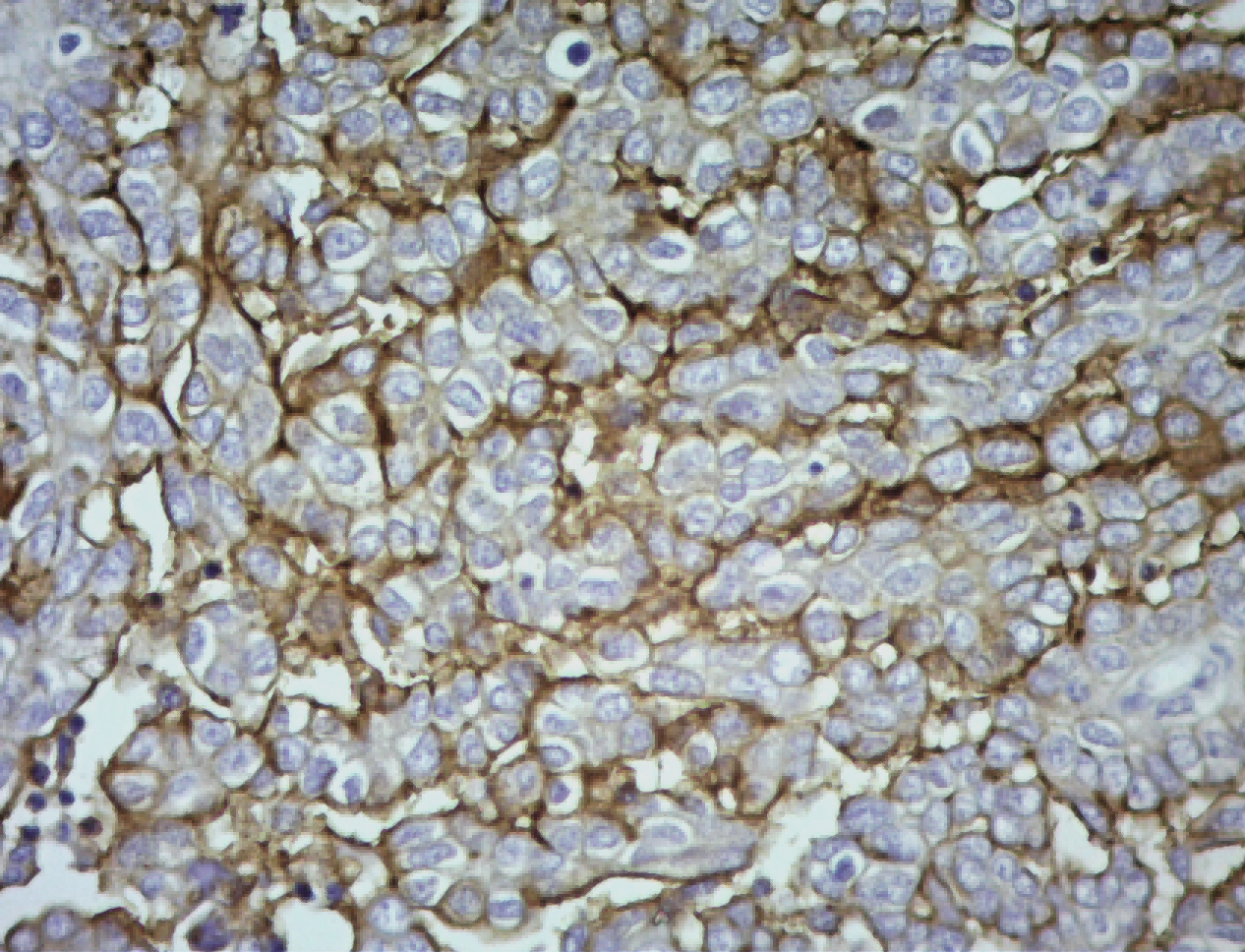
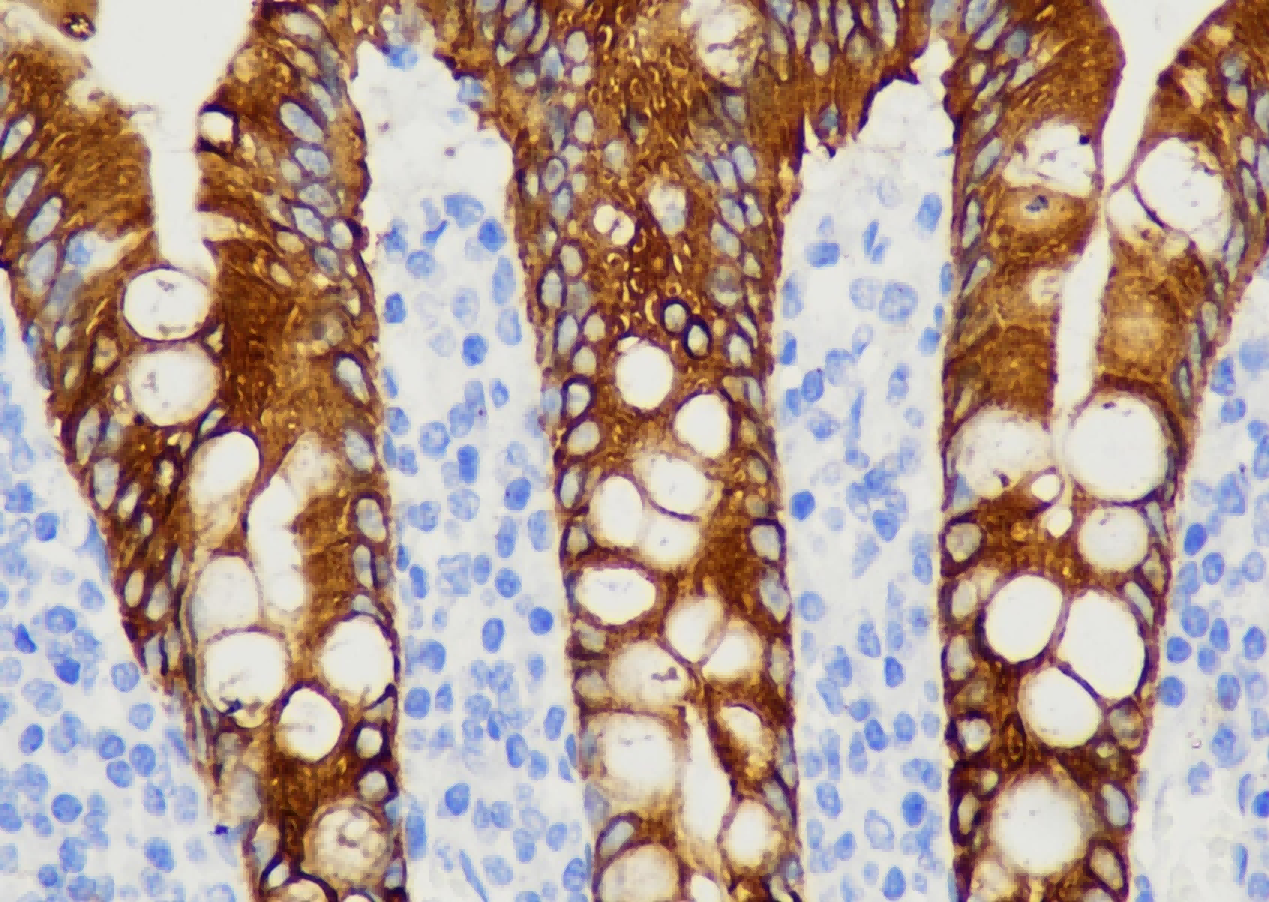
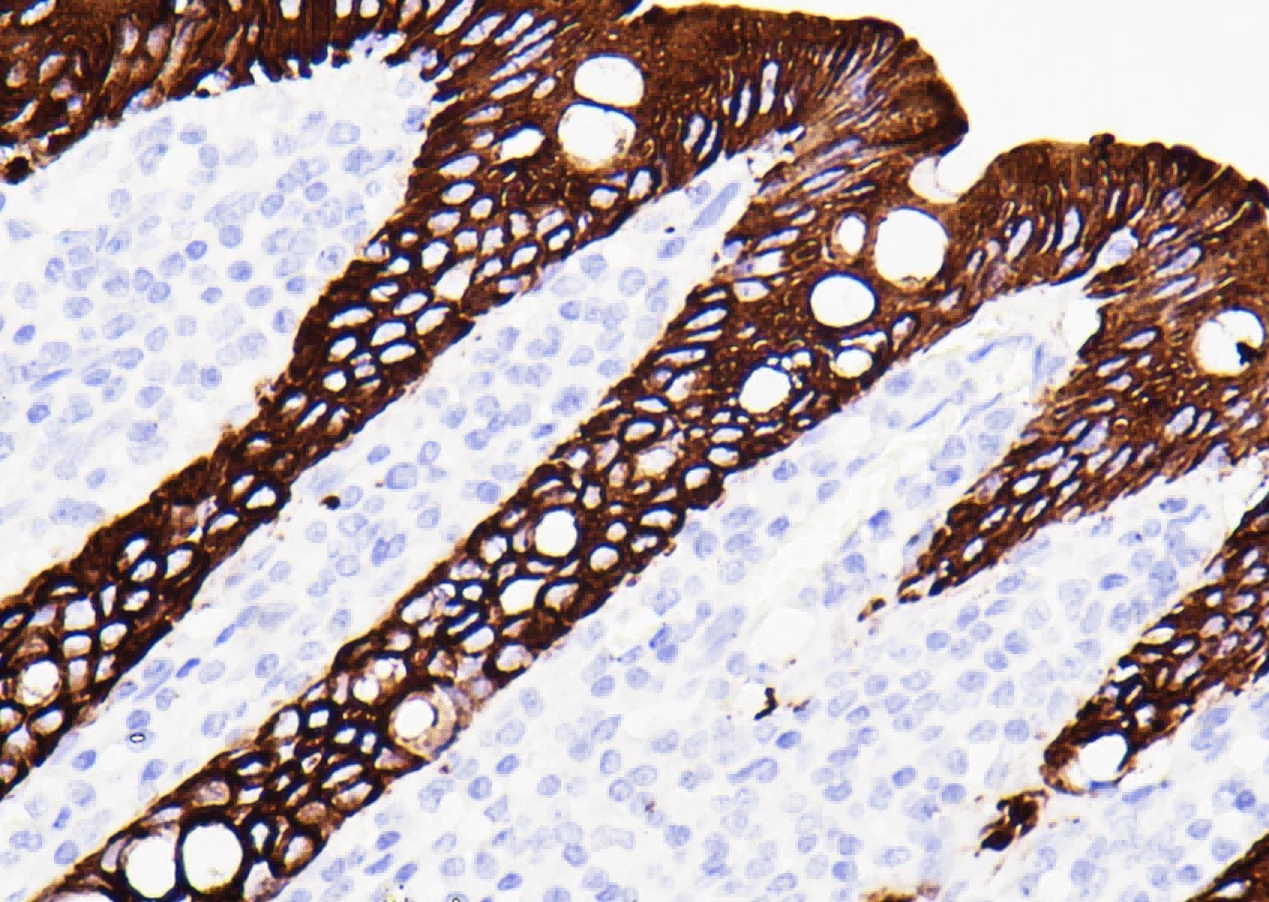
a. TDP-43 immunoreactivity was detected in the hypothalamus in mice injected with AAV-TDP43, including in the paraventricular nucleus (PVN) and lateral hypothalamic area (LHA), which contain neurons expressing oxytocin and vasopressin as well hypocretin and MCH, respectively.
内容:
展示了AAV-TDP43注射小鼠下丘脑的TDP-43免疫染色(高放大倍数),特别标示出室旁核(PVN)和外侧下丘脑区(LHA),并提示这些区域含有特定的神经肽神经元。 解读:
再次确认了TDP-43在下丘脑的成功表达和其分布,为后续定量分析这些区域的神经元提供了定位信息。这是对模型有效性的再次确认。 b. Mice overexpressing TDP-43 in the hypothalamus displayed reduced hypothalamic volume compared to uninjected control mice (p < 0.001).
内容:
箱线图显示了TDP-43过表达组和对照组下丘脑的体积测量数据。 解读:
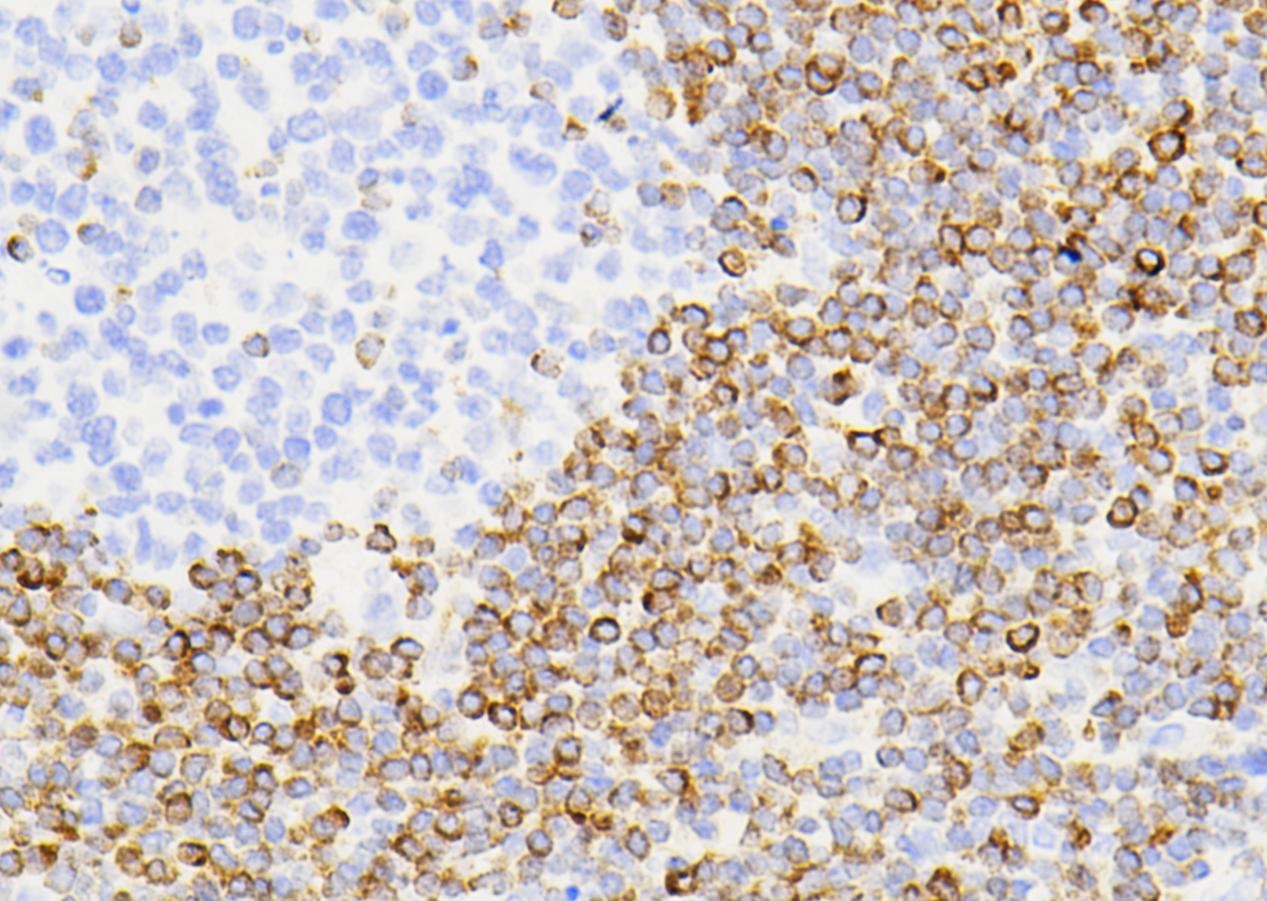
显著的统计学差异(p < 0.001)明确证实了TDP-43过表达导致下丘脑的宏观结构性损伤,即下丘脑萎缩。这是与人类神经退行性疾病中脑区萎缩相对应的关键病理特征。 c - d. Loss of hypocretin-expressing neurons was present in mice overexpressing TDP-43 in the hypothalamus compared to control mice (p < 0.001).
内容:
代表性图像(c)和箱线图(d)展示了食欲素神经元的定量计数结果。 解读:
定量数据(p < 0.001)明确证实了食欲素神经元的显著丢失(高达92%)。这呼应了图1b的定性观察,并提供了强有力的统计学证据。食欲素神经元在觉醒和代谢中扮演关键角色,其丢失提示可能存在相关功能障碍。 e - f. A similar pattern was observed in MCH-expressing neurons with significant reductions in mice overexpressing TDP-43 (p < 0.001).
内容:
代表性图像(e)和箱线图(f)展示了MCH神经元的定量计数结果。 解读:
与食欲素神经元类似,MCH神经元也显示出显著的丢失(高达90%,p < 0.001)。MCH神经元与能量平衡、睡眠和情绪有关,其丢失同样预示着相应的功能障碍。 g - h. The number of oxytocin-expressing neurons was reduced in mice overexpressing TDP-43 compared to control mice (p = 0.001).
内容:
代表性图像(g)和箱线图(h)展示了催产素神经元的定量计数结果。 解读:
催产素神经元也显示出显著的丢失(42%,p = 0.001),虽然不如食欲素和MCH神经元那么严重,但仍是显著的。催产素与社交行为和情绪调节有关,其丢失可能解释部分行为缺陷。 i - j. We observed no loss of vasopressin-expressing neurons.
内容:
代表性图像(i)和箱线图(j)展示了加压素神经元的定量计数结果。 解读:
无统计学差异(p = 1.000)。这是一个非常重要的发现,它表明TDP-43在下丘脑诱导的神经元丢失是选择性的,而非普遍的。这种选择性与临床ALS患者的病理特征高度吻合,极大地增强了模型的临床相关性和研究的严谨性,排除了非特异性毒性导致所有神经元死亡的可能性。
总结图2: 图2通过精确的定量数据,全面证实了TDP-43过表达导致下丘脑的宏观萎缩,并以高度选择性的方式导致食欲素、MCH和催产素神经元的丢失,而加压素神经元则未受影响。这种选择性病理与人类疾病的观察高度一致,奠定了模型用于功能研究的病理学基础。
Fig. 3: TDP-43 overexpression in the hypothalamus induces obesity and hyperglycaemia in mice.
(图3:下丘脑中的TDP-43过表达在小鼠中诱导肥胖和高血糖。)
核心目的: 探索TDP-43诱导的下丘脑病理对代谢功能的影响。
a. Mice overexpressing TDP-43 in the hypothalamus gained more weight compared to control mice injected with vehicle starting from 2 weeks post-injection.
内容:
折线图显示了TDP-43过表达组和对照组小鼠从注射后到实验结束的体重变化(百分比)。 解读:
TDP-43过表达小鼠从早期(2周)就开始表现出比对照组更快的体重增长,并在整个实验期间保持显著更高的体重增幅(p < 0.001)。这直接表明TDP-43过表达导致了体重增加。 b - c. Dual energy X-ray absorptiometry scans of vehicle-injected control (b) and AAV-TDP43-injected mice © revealed that mice overexpressing TDP-43 had higher body fat percentage than control mice (p < 0.001) (d).
内容:
DEXA扫描图像(b和c)直观展示了对照组和TDP-43过表达组小鼠的体脂分布,箱线图(d)显示了体脂百分比的定量数据。 解读:
DEXA扫描图像显示TDP-43过表达小鼠体脂更多,定量数据(p < 0.001)证实了TDP-43过表达导致小鼠出现肥胖。这与体重增加的发现相符,提供了更具体的代谢障碍证据。 e. We observed a significant increase in serum glucose levels in mice overexpressing TDP-43 compared to controls (p = 0.003).
内容:
箱线图显示了TDP-43过表达组和对照组小鼠的血清葡萄糖水平。 解读:
显著的统计学差异(p = 0.003)表明TDP-43过表达导致小鼠出现高血糖。这进一步证实了代谢调节的紊乱,提示可能存在胰岛素抵抗或葡萄糖利用障碍。 f. Spearman’s rank correlation test revealed a negative correlation for hypothalamic volume and percent body weight change (f), but no significant correlation for hypothalamic volume and serum glucose levels (g).
下丘脑体积与体重增加呈负相关(rho: -0.475, p = 0.040):
这意味着下丘脑萎缩越严重,小鼠体重增加越多。这在病理变化与功能表型之间建立了直接联系,支持了下丘脑损伤驱动代谢紊乱的假说。 下丘脑体积与血清葡萄糖水平无显著相关性:
可能高血糖的机制更为复杂,不完全由下丘脑萎缩程度决定,或者需要更大的样本量或更长时间的观察才能显现。 内容:
散点图显示了下丘脑体积与体重变化百分比(f)以及血清葡萄糖水平(g)之间的斯皮尔曼秩相关性。 解读:
h. Hypothalamic TDP-43 overexpression did not affect food intake at 4 and 8 weeks post-injection (h), despite higher body weight (i, p < 0.001 at both time-points).
内容:
箱线图显示了TDP-43过表达组和对照组小鼠在不同时间点的食物摄入量(h)和体重(i)。 解读:
尽管TDP-43过表达小鼠体重显著增加(i),但其食物摄入量在4周和8周时均无显著变化(p = 0.161, p = 0.073)。这是一个非常重要的发现,因为它表明肥胖和高血糖并非简单地由食物摄入过多引起。这意味着TDP-43在下丘脑的病理作用可能通过改变能量消耗、脂肪代谢或其他内分泌调节途径来导致代谢失调,而非仅仅影响食欲。
总结图3: 图3通过定量数据,有力地证明了下丘脑TDP-43过表达能够导致小鼠出现肥胖和高血糖的代谢紊乱,并揭示了这种代谢紊乱与下丘脑萎缩的相关性,且并非由食物摄入量增加直接引起。这些发现强调了下丘脑在TDP-43蛋白病代谢紊乱中的关键作用。
Fig. 4: Mice overexpressing TDP-43 in the hypothalamus show significantly reduced motor activity but maintain ability to swim.
(图4:下丘脑中过表达TDP-43的小鼠运动活性显著降低,但能维持游泳能力。)
核心目的: 探索TDP-43诱导的下丘脑病理对运动和情绪相关行为的影响。
a. Mice overexpressing TDP-43 travelled a shorter distance in the open field test than control mice injected with vehicle (p < 0.001).
内容:
箱线图显示了开放场测试中两组小鼠的移动距离。 解读:
显著的统计学差异(p < 0.001)表明TDP-43过表达小鼠在开放场中移动距离明显缩短,这直接证据表明其运动活性显著降低。 b. The rotarod test revealed that mice overexpressing TDP-43 had a shorter latency to fall from the device than control mice (p < 0.001).
内容:
箱线图显示了转棒测试中两组小鼠的跌落潜伏期。 解读:
显著的统计学差异(p < 0.001)表明TDP-43过表达小鼠在转棒上停留时间更短,这提示其运动协调性和平衡能力受损,或者其维持运动的动机降低。 c. Results from the elevated plus maze revealed that mice overexpressing TDP-43 in the hypothalamus also travelled shorter distances (c, p < 0.001), and that they spent more time in the center of the arena (d, p = 0.001) where the mice were placed at the start of the trial and less time on both closed (e, p = 0.011) and open arms (f, p = 0.012) compared to control mice.
移动距离显著缩短(p < 0.001):
再次印证了运动活性的普遍降低。 中心区域停留时间增加(p = 0.001):
小鼠通常会从高架十字迷宫的中心区域开始探索,但健康小鼠通常会迅速进入开放臂或封闭臂。在中心区域停留时间过长,可能不是焦虑增加(那样会倾向于封闭臂),而是缺乏探索动机或活动意愿降低的体现。 封闭臂和开放臂停留时间减少(p = 0.011, p = 0.012):
减少在手臂上的停留时间,尤其是开放臂,如果同时中心区域停留时间增加,则进一步支持了探索行为的普遍减少,而非单纯的焦虑或运动障碍。 内容:
箱线图分别显示了高架十字迷宫测试中两组小鼠的移动距离(c)、在中心区域停留时间(d)、在封闭臂停留时间(e)和在开放臂停留时间(f)。 解读:
g - h. However, overexpressing TDP-43 does not limit swimming ability (g - h).
不动时间无差异(p = 0.181):
这表明小鼠未表现出明显的抑郁样行为。 游泳时间无差异:
这是最关键的发现。尽管在开放场和转棒测试中运动活性显著降低,但在强迫游泳中,TDP-43过表达小鼠的游泳时间与对照组相似,表明它们并没有丧失基本的运动能力或肢体力量。 内容:
箱线图显示了强迫游泳测试中两组小鼠的不动时间(g)和游泳时间(h)。 解读:
结论:
运动活性降低并非由于严重的运动缺陷或瘫痪,而是可能源于动机、启动或探索意愿的下降。这为“类冷漠”这一行为表型的可能性提供了重要线索。
总结图4: 图4通过多项行为学测试,全面展示了下丘脑TDP-43过表达小鼠运动活性显著降低,探索行为减少。最重要的是,强迫游泳测试排除了严重运动功能障碍的可能性,为“类冷漠”这一更深层次的行为问题提供了证据。
Fig. 5: Mice overexpressing TDP-43 in the hypothalamus displayed reduced nesting behavior.
(图5:下丘脑中过表达TDP-43的小鼠筑巢行为降低。)
核心目的: 提供更直接的证据来支持“类冷漠”行为,并确认模型中的TDP-43过表达水平和初步基因表达变化。
a - b. Representative images of cages containing mice with hypothalamic injections of either vehicle control (a) or AAV-TDP43 (b), with the corresponding nesting scores are 3 (highest score) and 0 (lowest score), respectively.
内容:
展示了对照组(a)和TDP-43过表达组(b)小鼠笼子中筑巢材料的代表性图像,并附有对应的筑巢评分(3分:完整穹顶状巢,0分:材料未触碰)。 解读:
直观对比显示,对照组小鼠积极筑巢并形成了良好的巢穴,而TDP-43过表达组小鼠几乎未触碰筑巢材料。这提供了一个强有力的视觉证据,表明TDP-43过表达小鼠缺乏筑巢这种日常活动的动机和能力。 c. Mice overexpressing TDP-43 in the hypothalamus displayed decreased nesting behavior compared to control mice at 8 weeks post-injection (p = 0.016), but no difference was observed at 4 weeks post-injection.
4周后无差异(p = 0.290):
表明早期筑巢行为未受影响。 8周后显著降低(p = 0.016):
筑巢评分从对照组的中位数2降至TDP-43过表达组的中位数1。这表明随着病程的进展,TDP-43过表达小鼠的筑巢行为能力下降,即动机和日常活动能力受损。筑巢行为被认为是衡量小鼠动机和冷漠的良好指标,因此这一结果提供了支持“类冷漠”行为的关键证据,与图4的推断相符。 内容:
箱线图显示了4周和8周后两组小鼠的筑巢评分。 解读:
d. Increased levels of TARDBP/Tardbp mRNA confirmed TDP-43 overexpression in the hypothalamus.
内容:
箱线图显示了TDP-43过表达组和对照组下丘脑中总TDP-43 (TARDBP/Tardbp) mRNA水平。 解读:
TDP-43过表达组的mRNA水平显著高于对照组,再次确认了AAV载体在下丘脑中成功且高效地表达了TDP-43。这是后续RNA测序和分子机制分析的基础。
总结图5: 图5通过筑巢行为测试,直接提供了TDP-43过表达导致小鼠出现“类冷漠”行为的证据,并证实了TDP-43在mRNA层面的高表达。这使得行为表型的解释更加精确和具有临床意义。
Fig. 6: Nuclear and cytoplasmic localization of TDP-43 with inclusions following AAV-TDP43 vector injection in the hypothalamus of mice.
(图6:AAV-TDP43载体注射小鼠下丘脑中TDP-43的核内和胞浆内定位及包涵体。)
核心目的: 深入探究TDP-43过表达在亚细胞水平的病理学特征,验证其是否重现了ALS/FTD的标志性分子病理。
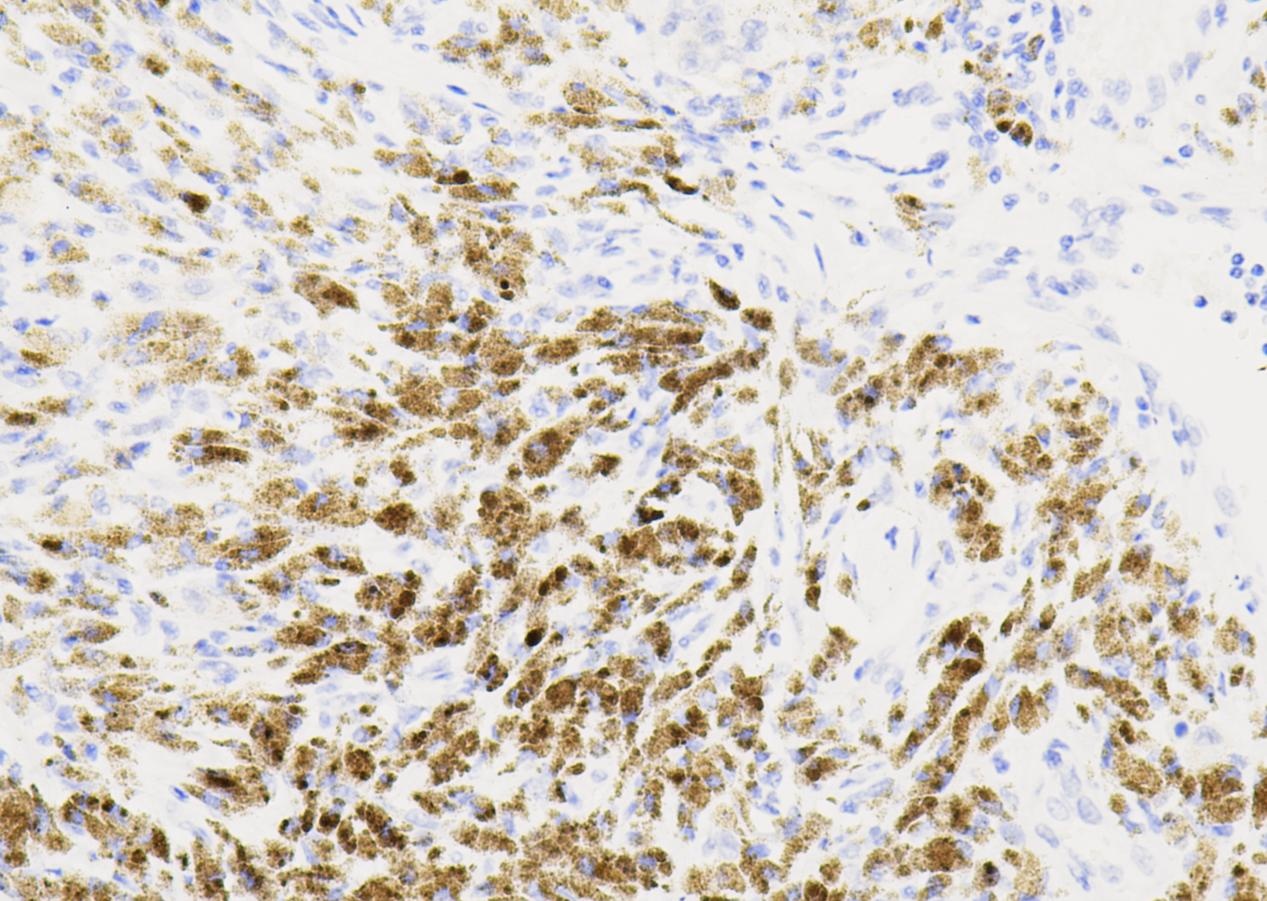
a - b. Immunohistochemistry for TDP-43 was performed on brains with hypothalamic injections of either AAV-TDP43 (a) or vehicle (b) and counterstained with Hoechst for nuclear localisation.
内容:
荧光免疫染色图像,显示TDP-43过表达组(a)和对照组(b)下丘脑中的TDP-43(绿色荧光)和Hoechst(蓝色荧光,核染料)。 解读:
对照组(b)的TDP-43主要集中在细胞核内,荧光强度较低。TDP-43过表达组(a)则显示了显著增强的TDP-43信号,且分布在核内和胞浆中,提示存在异常。 c. TDP-43 immunoreactivity was present in both the nucleus © and the cytoplasm (d).
内容:
更高放大倍数的图像,显示了单个细胞中TDP-43在核内(c)和胞浆内(d)的典型分布。 解读:
清晰地展示了TDP-43的核-浆易位(nuclear-to-cytoplasmic mislocalization)。在ALS/FTD中,TDP-43从细胞核易位到细胞质是其功能障碍和病理聚集的关键一步。这一发现表明该小鼠模型在分子病理层面高度模拟了人类疾病。 e. Both nuclear (e) and cytoplasmic (f) inclusions of TDP-43 were present.
内容:
更高放大倍数的图像,显示了TDP-43阳性的核内包涵体(e)和胞浆内包涵体(f)。 解读:
确认了TDP-43过表达不仅导致核-浆易位,还形成了TDP-43包涵体。这些包涵体是ALS/FTD的病理标志。虽然胞浆内包涵体更为普遍,核内也存在,这进一步增强了模型的临床相关性。
总结图6: 图6通过精细的荧光免疫染色,从亚细胞层面证实了TDP-43过表达导致了其核-浆易位和包涵体形成,这些都是TDP-43蛋白病的标志性分子病理特征,从而将模型与人类疾病的分子机制紧密联系起来。
Fig. 7: Overexpression of TDP-43 leads to skipping of specific constitutive exons, but not to the inclusion of neuron-specific cryptic exons.
(图7:TDP-43过表达导致特定组成性外显子跳跃,但未导致神经元特异性隐匿性外显子插入。)
核心目的: 探索TDP-43过表达对其RNA结合和剪接功能的影响,特别关注剪接异常的类型。
a. RNA-sequencing analysis of frozen hypothalamic tissues revealed several examples of exon skipping in Mrlp45, Ddi2, and Psmd14 (black arrowhead) in mice with TDP-43 overexpression.
内容:
展示了RNA测序Sashimi plot(剪接图),用黑色箭头指示了TDP-43过表达组中Mrlp45、Ddi2和Psmd14基因的外显子跳跃事件。Sashimi plot可视化了不同剪接异构体以及连接不同外显子的“read junction”数量,显示跳跃事件的频率。 解读:
图中剪接连接线(弧线)在TDP-43过表达组中,绕过中间外显子的连接线(表示外显子跳跃)明显增多,而包含该外显子的连接线减少。这直观地展示了TDP-43过表达导致了这些基因的组成性外显子跳跃。 b. Quantification of events was performed by calculating the frequency of exon skipping events in the AAV-TDP43 or vehicle injected group.
内容:
箱线图定量显示了Mrlp45、Ddi2和Psmd14基因的组成性外显子跳跃频率。 解读:
统计学分析(p < 0.05 或 p < 0.01)明确证实了TDP-43过表达组的组成性外显子跳跃频率显著高于对照组。这与文献报道的TDP-43过表达导致组成性外显子跳跃的现象一致,揭示了TDP-43功能获得性毒性的一种分子机制。 c. RNA-sequencing analysis does not reveal the expression of cryptic exons in Ap3b2 © Camk1g (d) (black arrowheads).
内容:
Sashimi plot展示了Ap3b2(c)和Camk1g(d)基因的剪接模式,并用黑色箭头指示了通常与TDP-43缺失相关的隐匿性外显子区域。 解读:
在TDP-43过表达组中,这些隐匿性外显子的表达(通过额外的剪接连接线表示)并未显著增加。这与TDP-43缺失导致隐匿性外显子插入的现象形成对比,提示了TDP-43过表达和缺失可能通过不同的分子机制引起剪接异常,或者隐匿性外显子的表现具有细胞类型特异性。这一发现对于理解TDP-43的功能获得和功能丧失机制的复杂性具有重要意义。
总结图7: 图7通过RNA测序结果,揭示了TDP-43过表达在下丘脑中导致了组成性外显子跳跃的剪接异常,但未发现其导致隐匿性外显子插入(至少在这些特定基因中)。这为TDP-43的病理机制提供了更具体的分子层面解释。
Fig. 8: Schematic representation of the molecular phenotype, hypothalamic pathology, and behavioral dysfunction induced by AAV-mediated overexpression of human wild-type TDP-43 in the hypothalamus, recapitulating key neuropathological features observed in clinical ALS and metabolic and psychiatric features seen in TDP-43 proteinopathies.
(图8:人野生型TDP-43在下丘脑中AAV介导过表达诱导的分子表型、下丘脑病理和行为功能障碍的示意图,重现了临床ALS中观察到的关键神经病理特征以及TDP-43蛋白病中可见的代谢和精神特征。)
核心目的: 总结并整合本研究的所有主要发现,以视觉化方式呈现TDP-43驱动的病理过程和多重表型。
内容: 这是一个概念性的总结图,将论文中分散的发现汇聚成一个连贯的因果链条。
Reduced motor activity (运动活性降低)。 Reduced nesting behavior (筑巢行为降低)。 Reduced exploratory behavior (探索行为降低)。 Maintained swimming ability (游泳能力维持)。 Suggesting Apathy-like phenotype (提示类冷漠表型)。
Increased body weight (体重增加)。 Increased body fat (体脂增加,肥胖)。 Hyperglycaemia (高血糖)。 No change in food intake (食物摄入量无变化)。 Hypothalamic atrophy (下丘脑萎缩)。 Selective loss of hypocretin, MCH, oxytocin neurons (食欲素、MCH、催产素神经元选择性丢失)。 Astrogliosis & microglial activation (星形胶质细胞增生与小胶质细胞激活)。 TDP-43 nuclear-to-cytoplasmic mislocalization (TDP-43核-浆易位)。 Nuclear & cytoplasmic TDP-43 inclusions (核内和胞浆内TDP-43包涵体)。 Increased ubiquitin (泛素化增加)。 Constitutive exon skipping (组成性外显子跳跃)。 TDP-43 overexpression in hypothalamus (AAV-TDP43 injection):
研究的起始点,即在下丘脑中诱导TDP-43过表达。 Molecular Pathology:
Hypothalamic Pathology:
Dysregulated Metabolism:
Impaired Behavior:
Contribution to Non-Motor Phenotype in TDP-43 Proteinopathies (对TDP-43蛋白病非运动表型的贡献)。
解读: 图8是一个极好的视觉化摘要,它清晰地描绘了研究从基因操作(TDP-43过表达)到微观分子病理(易位、包涵体、剪接),再到宏观组织病理(萎缩、神经元丢失、炎症),最终导致功能性缺陷(代谢失调、行为障碍)的整个因果链条。它强调了下丘脑作为中心枢纽,其TDP-43病理如何直接导致TDP-43蛋白病中的非运动性临床表现。通过将这些复杂的发现整合到一个简明的示意图中,它强化了论文的核心结论,并强调了模型的临床相关性。
总结图8: 图8是对整个研究的最高层次概括和总结,将所有关键发现整合在一起,直观地呈现了TDP-43在下丘脑中的病理作用及其对代谢和行为的全面影响,并突出了其对TDP-43蛋白病非运动性表型贡献的意义。